過去の研究組織 (2011-2018)
過去の研究組織 (2011-2018)
 ファンディングエージェンシー
ファンディングエージェンシー
科学技術振興機構 (JST) 戦略的創造研究推進事業 (CREST)
日本医療研究開発機構 (AMED) 革新的先端研究開発支援事業 (AMED-CREST)
「エピゲノム研究に基づく診断・治療へ向けた新技術の創出」
山本 雅之
東北大学大学院医学系研究科
教授
牛島 俊和
国立がん研究センター研究所
エピゲノム解析分野・分野長
 研究チーム
研究チーム

金井チーム
研究代表者
金井 弥栄 (かない やえ)
慶應義塾大学医学部・教授
国立がん研究センター研究所分子病理分野・分野長
私たち国立がん研究センター研究所分子病理分野の研究者は、日本病理学会が認定する病理専門医でもあって、国立がん研究センター中央病院にも併任し、毎日多数のがん患者さんの生検・手術検体の病理診断を行っています。研究者の視点で病理診断を行い、一人一人の患者さんのがんの個性について、治療指針になる情報を主治医達に少しでも多く提供したいと考えています。他方で、私たちが顕微鏡で日々観察しているがんの形態学的多様性 (heterogeneity)は、がんの生物学的特性を反映するもので、多段階発がん過程の進展の証と考えています。そして、外科病理診断の実践を通して得た着想を基盤に、診療に還元できるリアリティーのあるがん研究をしたいと常に念じています。
従来、がんは遺伝子の変異・増幅・染色体構造異常等の蓄積でおこると理解されてきました。しかし、がんの形態学的多様性の全てを、ジェネティックな異常のみでは充分に説明できないことから、私たちは発がんにおけるエピジェネティック機構にいち早く着目しました。
私がこの分野の論文を初めて刊行したのが1995年でしたが、これはがんのエピジェネティクス研究の黎明期にあたりました。前がん状態にDNAメチル化異常が見られることは今や世界の定説で、自分ではそれを最も早く指摘した一人と自負しています。しかし当初は、がん遺伝子時代の価値観に受け入れられず、「肝がんではない肝硬変で変化しているのだから、DNAメチル化異常は肝発がんと関係ない事象である」との査読者のコメントと格闘しなければなりませんでした。その後、ウイルスの持続感染等を伴う慢性炎症や喫煙と、DNAメチルトランスフェラーゼの異常を伴うDNAメチル化異常の関連を、病理組織検体において詳細に解析してきました。エピジェネティックな異常のゲノム網羅的解析すなわちエピゲノム解析が可能になると、前がん段階におけるDNAメチル化異常はエピジエネティック・ジェネティックな異常をさらに誘導して、生じるがんの悪性度と症例の予後を規定することが分かってきました。また、維持メチル化機構で安定に保持され、微量の体液検体等で高感度解析が可能なDNAメチル化異常は、診断指標として優れています。そこで私たちは、諸臓器がんの発がんリスク診断法・予後診断法を開発して、臨床検査としての実用化を目指しています。
他方では、ヒトの検体の解析から臨床応用可能な知見を得るために、組織・細胞系列毎に多様性があるエピゲノムの本質を避けては通れません。解析技術と情報処理技術が進歩を遂げた現在こそ、ヒト細胞のエピゲノムの多様性を明らかにすべきで、IHECの理念には強く共感致します。発がんの外的要因が前がん段階からエピゲノムに影響する様子を解析してきたので、環境要因に応じたエピゲノムの多様性にも大いに興味を持っています。このたび、IHEC対応型CRESTに採用して頂き、日本チームのひとつとして、エピゲノムの多様性解明を掲げたIHECに参画することが許されました。ファンディングエージェンシーであるJST・我が国のIHECへの参加を後押ししてくれた諸学会と、私のチームに加わってくれた共同研究者の先生方に深く感謝しております。多数の日本人から得られた純化細胞の標準エピゲノムプロファイルを決定して、世界共有の研究基盤となるデータベースを充実させて国際貢献を果たし、歴史に残る仕事をしたいと考えています。疾患エピゲノム研究者としては、IHECの成果を疾患特異的エピゲノムプロファイルの効率的で正確な同定に活かし、エピゲノム診断・治療のブレイクスルーにつなげたいと考えています。
さらに私たちは、植物からヒトまで、あるいは基礎生物学から臨床医学までの、我が国の多くのエピゲノム研究者の代表としてIHECに参加させて頂いていることを肝に銘じています。国際コンソーシアムにおいて我が国のプレゼンスを示すとともに、本ホームページの運営やシンポジウム開催等を通して、解析技術や研究動向に関するIHECで得られた情報をいちはやく我が国の研究者に伝達し、我が国のエピゲノム研究の更なる隆盛に寄与したいと考えています。
| 研究代表者 | |
| 金井 弥栄 (かない やえ) |
慶應義塾大学医学部・教授 国立がん研究センター研究所分子病理分野・分野長 課題名「研究の総括とヒト消化器上皮細胞の標準エピゲノム解析」 |
| 主たる共同研究者 | |
| 柴田 龍弘 (しばた たつひろ) |
国立がん研究センター研究所がんゲノミクス研究分野・分野長 課題名「ヒト消化器上皮細胞の標準エピゲノム解析と解析技術開発」 |
| 伊藤 隆司 (いとう たかし) |
九州大学大学院医学研究院医化学分野・教授 課題名「ヒト消化器上皮細胞の標準エピゲノム解析と解析技術開発」 |
| 鈴木 穣 (すずき ゆたか) |
東京大学大学院新領域創成科学研究科・教授 課題名「ヒト消化器上皮細胞の標準エピゲノム解析と解析技術開発」 |

白髭チーム
研究代表者
白髭 克彦 (しらひげ かつひこ)
東京大学分子細胞生物学研究所・教授
エピゲノム疾患研究センター・センター長
最近、エピジェネティクス、エピゲノムという言葉を耳にする機会が多いと思います。エピジェネティクスとはDNAの配列変化を伴わずに細胞から細胞へ、世代から世代へ継承されうる遺伝子発現制御メカニズムのことを指し、エピゲノムとは、エピジェネティクスを規定するヒストン修飾やDNAのメチル化修飾、の全ゲノムレベルでの状態を指します。エピジェネティックな制御は発生、分化過程を含め、ありとあらゆる細胞の個性を規定しているため、その制御メカニズムの探求は細胞レベルだけではなく個体レベルでの生命の理解に必須です。エピジェネティクス、エピゲノムというと何やら呪文のような不可解な印象がありますが、一昔前のいわゆる転写制御研究と本質的に同じものです。
こういったエピゲノム解析に欠かせない技術の一つが次世代シークエンサーを用いたタンパク結合部位の網羅的プロファイリング技術、ChIP-seq解析と呼ばれるものです。我々のグループは油谷浩幸先生のグループ(東京大学先端科学技術研究センター)と共に、このタンパクプロファイル解析(ChIP-chipおよびChIP-seq解析)では世界的に見ても草分け的存在です。ChIP-seq解析と言いますと誰でも出来る技術として既に完成されたものであるという印象を持たれるかもしれません。しかし、実際はまだまだ発展途上の技法です。IHECでは、この15年間の間に我々が培ったノウハウを生かしつつ、ChIP-seqの現状での問題点を克服して行きたいと考えています。特に、本課題では2つのChIP-seqの抱える問題点についてその解決を目指したいと考えています。一つ目は解析に必要なサンプル量です。従来のChIP-seq解析では一つの解析に必要な細胞数はおよそ100万個から1000万個でした。しかし、これでは実際の病理組織をはじめ貴重なヒトの組織サンプルで解析を行う事は不可能です。そこで、まず、ChIP-seq解析系をより少数の組織、細胞(10000から1000細胞程度。少なければ少ないほど良い)で実施可能な系へ展開して行きます。2番目に、未だ一般には認識されていないChIP-seq解析系のバックグラウンドについて正しく評価できる系を構築したいと考えています。このバックグラウンドの問題というのは非常に深刻で、我々は経験的に転写活性の高い遺伝子のプロモーター、コーディング領域が非特異的なバックグラウンドになり易い事を知っています。ChiP-seq法により解析されている因子の大半は転写と関係する因子ですから、このようなバックグラウンドの問題は放置できないはずなのですが、世の中で発表されている仕事の多くでは、この問題は基本的に論じられずに今日に至っています。われわれは現在、この課題の中で、其の原因の解明と解決法の開発に取り組み、徐々にではありますが成果を上げつつあります。以上のような基本的問題点を克服しつつ、IHECの標的組織としてはヒトの12種類におよぶ血管内皮細胞について順次そのエピゲノム情報を明らかにして行きます。
| 研究代表者 | |
| 白髭 克彦 (しらひげ かつひこ) |
東京大学分子細胞生物学研究所・教授 エピゲノム疾患研究センター・センター長 課題名「エピゲノム解析の国際標準化に向けた新技術の創出」 |
| 主たる共同研究者 | |
| 和田 洋一郎 (わだ よういちろう) |
先端科学技術研究センター・教授 課題名「標準エピゲノム解析 ・病態エピゲノム解析 ・新規エピゲノム解析技術の開発」 |
| 木村 宏 (きむら ひろし) |
東京工業大学 生命理工学研究科 教授 課題名「オリゴクローナル抗体の開発」 |
| 光山 統泰 (みつやま とうたい) |
産業技術総合研究所 人工知能研究センター・研究チーム長 課題名「エピゲノム情報解析パイプラインの構築 ・エピゲノムデータベースの構築」 |

佐々木チーム
研究代表者
佐々木 裕之(ささき ひろゆき)
九州大学生体防御医学研究所エピゲノム制御学分野・教授
九州大学エピゲノムネットワーク研究センター・センター長
私たちの研究チームは、長年にわたり哺乳類の正常発生を制御するエピジェネティクスの仕組みを研究してきました。基本的なメカニズムの解明にはマウスを用い、これまでに、哺乳類の正常発生に必要なゲノムインプリンティング現象に配偶子のDNAメチル化が必須であること、哺乳類の生殖細胞にpiRNAやsiRNAなどの特殊な小分子RNAによる遺伝子発現制御があることなどを発見しました。それらの研究成果はすでにネイチャー、サイエンスなどの国際誌に発表しています。
一方、もともと医師である私は、このような基礎的な研究成果をヒトの病気の解明に役立てたいと考えてきました。私たちの研究領域では不妊、不育症、先天的な子どもの病気、小児や成人女性のがんが問題となっており、最近では胎児期の栄養状態が成人病の発症に関わることも示されています。また、エピジェネティクスは生殖補助医療や再生医療の発展にも重要です。今回、国際ヒトエピゲノムコンソーシアム(IHEC)へ参加するにあたり、私たちが着目したのは胎盤と子宮内膜です。これらはゲノムインプリンティングの研究においても非常に重要な器官(組織)でした。そもそもゲノムインプリンティングは数ある動物の中で有胎盤哺乳類にしか見られない現象で、そのためインプリンティングの進化には母体からの栄養供給が関係していると考えられています。また、胎盤におけるインプリンティングにはDNAメチル化が関与しないなど、この器官だけのユニークなエピジェネティックな制御も見られます。そして、これらの器官は様々な疾患と関連しています。
本研究では、正常な胎盤および子宮内膜に由来する細胞の標準エピゲノムを決定することで国際ヒトエピゲノムコンソーシアム(IHEC)に貢献し、このデータを様々な疾患の研究に役立てる基盤を作ります。そのため、新たなエピゲノム解析技術の開発にも挑みます。また、取得した標準エピゲノムを妊娠高血圧症候群(妊娠中毒症)、胞状奇胎、子宮内膜症に由来する細胞のエピゲノムと比較し、これらの疾患の病態と原因を解明するための突破口を作りたいと考えています。我々の研究課題名は「生殖発生に関わる細胞のエピゲノム解析基盤研究」です。
本研究を開始するにあたり、産婦人科領域の研究者が率いるふたつの研究室と、バイオインフォーマティクスの専門家が率いる研究室に参加を願い、合計4研究室がタッグを組む体制を整えました。最強のチームを編成できたと考えています。私たちは本研究の遂行を通して、エピゲノム研究の推進と世界の人々の健康維持に広く貢献することを目指します。
| 研究代表者 | |
| 佐々木 裕之 (ささき ひろゆき) |
九州大学生体防御医学研究所・教授 課題名 「生殖系エピゲノム解析基盤研究」 |
| 主たる共同研究者 | |
| 有馬 隆博 (ありま たかひろ) |
東北大学大学院医学系研究科・教授 課題名 「胎盤と関連疾患のエピゲノム解析」 |
| 秦 健一郎 (はた けんいちろう) |
国立成育医療研究センター研究所・部長 課題名 「子宮内膜と関連疾患のエピゲノム解析」 |
| 須山 幹太 (すやま みきた) |
九州大学生体防御医学研究所・教授 課題名 「エピゲノムデータに基づく生殖系遺伝子発現制御機構の解明」 |
 研究概要
研究概要
 IHEC日本チームが解析対象とする細胞種
IHEC日本チームが解析対象とする細胞種
| 金井チーム | |
| 肝 liver |
肝細胞 hepatocyte 肝幹細胞 hepatic stem cell クッパー細胞 Kupffer cell 類洞内皮細胞 sinusoidal endothelial cell |
| 大腸 large intestine |
上行結腸吸収上皮細胞 absorptive epithelial cell of the ascending colon S状結腸吸収上皮細胞 absorptive epithelial cell of the descending colon 直腸吸収上皮細胞 absorptive epithelial cell of the rectum |
| 胃 stomach |
表層粘液細胞 surface epithelial cell 腺頚部増殖帯上皮細胞 mucous neck cell 胃底腺細胞 fundic gland |
| 腎 kidney |
近位尿細管上皮細胞 proximal tubules 遠位尿細管上皮細胞 distal tubules |
| 佐々木チーム | |
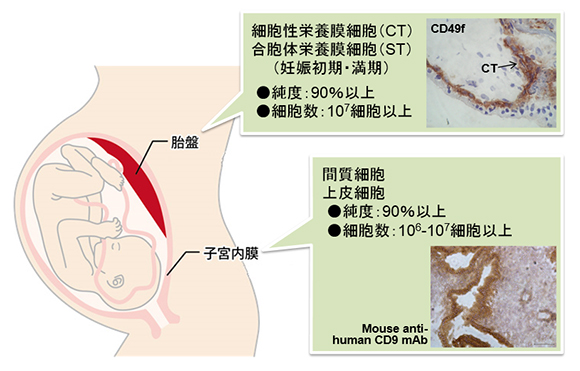
| 胎盤 placenta |
細胞性栄養膜細胞(妊娠初期) cytotrophoblast (first trimester) 細胞性栄養膜細胞(満期) cytotrophoblast (term) 合胞体栄養膜細胞(妊娠初期) syncytiotrophoblast (first trimester) 合胞体栄養膜細胞(妊娠中期) syncytiotrophoblast (second trimester) 絨毛外栄養膜細胞(妊娠初期) extravillous trophoblast (first trimester) |
| 子宮 uterus |
子宮内膜上皮細胞(増殖期) endometrial epithelial cell (follicular phase) 子宮内膜上皮細胞(分泌期) endometrial epithelial cell (secretory phase) 子宮内膜間質細胞 endometrial stroma cell |
 金井チーム
金井チーム
概要
本研究は、我が国の代表研究チームとしてIHECに参加・貢献しようとするものです。IHECは "1000エピゲノム (thousand epigenomes)"すなわち1000細胞系列・人の標準エピゲノムプロファイル決定を目標に掲げ、臓器・細胞系列・性別・年齢・環境要因等によるエピゲノムの多様性を明らかにして、人類共通の研究基盤とすることを目指しています。当IHEC対応型CREST研究チームにおいては、肝細胞・肝幹細胞・クッパー細胞・肝類洞内皮細胞・胃表層粘液細胞・胃腺頚部増殖帯上皮細胞・胃底腺細胞・上行結腸吸収上皮細胞・S状結腸吸収上皮細胞・近位尿細管上皮細胞・遠位尿細管上皮細胞等の標準エピゲノム決定を分担します。我が国においては、胃がん・肝がんの罹患率が高く、私たちは胃がん・肝がん等消化器がん等のエピゲノム異常の研究成果を蓄積しているので、国際競争力のさらなる増強を目指し、消化器等を対象として選択しました。
2011年5月13日以降国立がん研究センターを受診し、新包括同意体制のもと、ヒトゲノム・遺伝子解析研究に供する可能性についてリサーチ・コンシェルジェから十分な説明を受け、診療後余剰検体の研究利用に対し文書で同意した症例を対象とします。手術材料のうち、国立がん研究センター中央病院病理・臨床検査科スタッフあるいは国立がん研究センター中央病院病理・臨床検査科に併任する研究所スタッフであり、日本病理学会認定病理専門医である臓器担当病理医によって、病理診断に支障を来さない部位から患者に不利益を及ぼさずに研究のために採取された組織を用います (図1)。
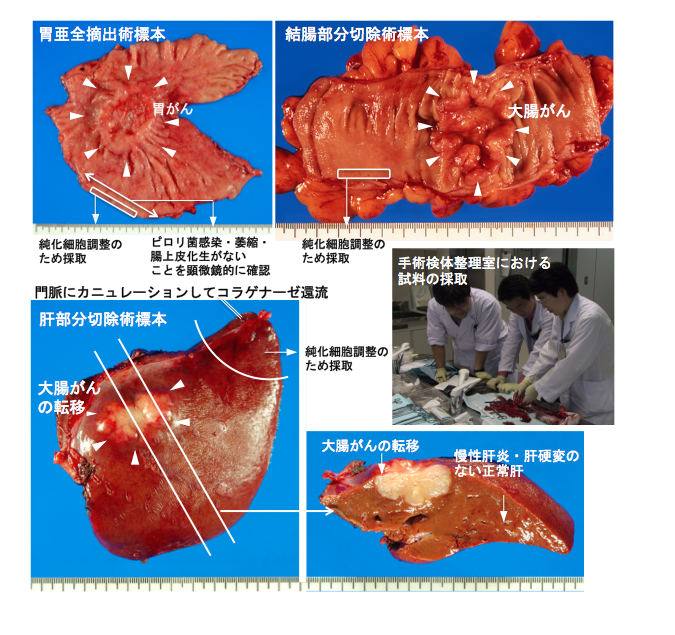
図1 試料の採取状況。手術検体が提出されると直ちに、すなわち細胞・核酸が変性する前に、研究者は自ら豊富な試料を繰り返し採取できる。
本研究は、国立がん研究センター研究倫理審査委員会より承認を得て (課題番号2012-095 「ヒト消化器ならびに泌尿器上皮細胞の標準エピゲノム解析」 研究代表者: 金井 弥栄)、「ヒトゲノム・遺伝子解析研究に関する倫理指針」を遵守して実施します。中央病院ゲノム研究個人情報管理室において、連結可能匿名化して解析をすすめます。
組織検体のコラゲナーゼ消化・蛍光活性セルソーター (FACS: fluorescence-activated cell sorting) 精製により、高品質の純化細胞を調製して、次世代シークエンサを用いて、バイサルファイト変換全ゲノムショットガンシークエンシング・クロマチン免疫沈降シークエンシング (ChIP-seq: Chromatin Immunoprecipitation-sequencing)・非コードRNA解析を施行します。IHEC標準の方法に加え、post–bisulfite adaptor-tagging (PBAT)法等独自の解析手技・アルゴリズムを用い、高品質のデータを産出します。極微量試料におけるエピゲノム解析技術や、5-ヒドロキシメチルシトシンの解析技術の開発も進めます。獲得した標準エピゲノムプロファイルは、IHECの要請に従って、JSTバイオサイエンスデータベースセンター (NBDC: National Bioscience Database Center) 等を介して、試料等提供者個人を全く特定出来ない形で広く公開致します。
公開されたデータはIHECの成果の一部として、世界の研究者に広く共有され、疾患特異的エピゲノムプロファイルの効率的かつ正確な同定を促進し、疾患研究に大きく貢献することが期待されます。当チーム自体においても、前がん段階にある細胞・がん細胞におけるエピゲノムプロファイルを同様に決定し、標準エピゲノムプロファイルと比較して、がんの診断薬・治療薬創薬標的同定を行います。
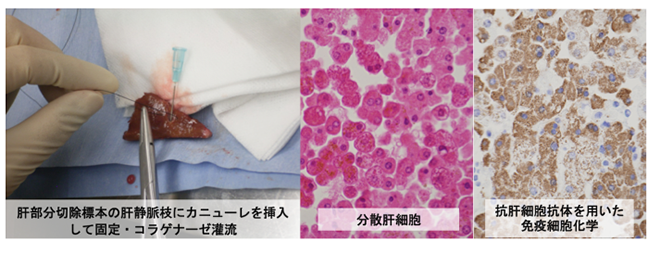
図2 手術検体からの肝細胞の純化
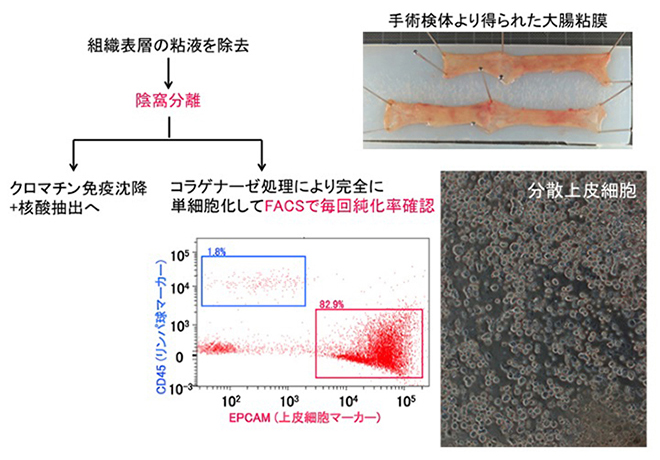
図3 手術検体からの大腸吸収上皮細胞の純化
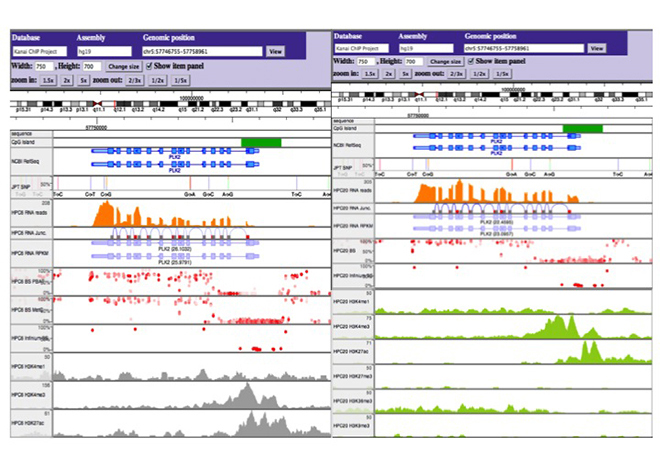
図4 独自に開発したエピゲノムブラウザ
 白髭チーム
白髭チーム
概要
本研究は、新規エピゲノム解析技術の開発に取り組み、新たなエピゲノムマーカーおよびその標準化解析技術の提案を行うとともに心臓—血管系、特に、血管内皮細胞を対象としたエピゲノム解析を大規模に展開し、データ、技術両面で国際ヒトエピゲノムコンソーシウム(IHEC)に貢献することを目的とします。具体的には、1)新規エピゲノムマーカーの探索(既知のヒストン修飾のうち機能的な意味付けがなされていないものについて、ゲノムワイドな局在情報からその機能を探る)、2)オリゴクローナル抗体取得によるヒストン修飾解析標準化技術の確立、3)微量組織を用いたエピゲノム解析技法の確立(RNA-seqは100細胞、ChIP-seq解析は1万細胞での技術確立を目指す)、4)心血管系内皮細胞(組織12種類、性別含め24種類)のIHECの手順にのっとった大規模解析、を行います(図1)。確立される技術については、エピゲノム解析標準化手法としてIHECに提案を行います。心血管内皮細胞12種のエピゲノムデータについてはデータベースを構築しIHEC参画機関間でデータの共有を行うだけでなく、広くデータを公開し、血管新生、がん研究等の基礎研究のみならず日本人の3大死因の一つである心血管疾患のエピゲノム創薬に役立てます。
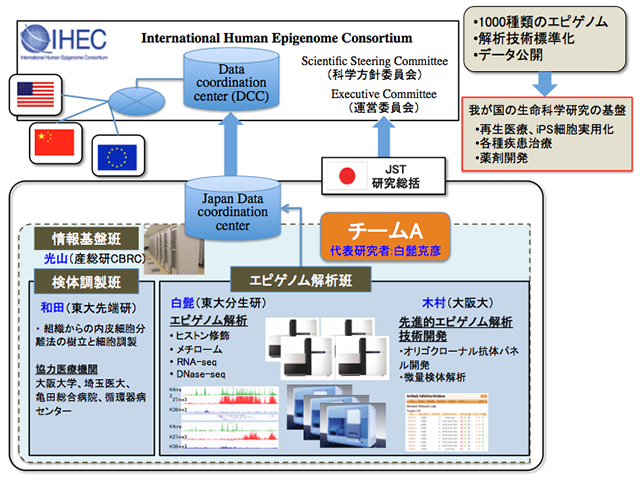
図1
全身に分布する血管系(図2)は、周囲の環境、分布する組織毎に外界からの刺激を受けるばかりか、肺からの距離に応じて変化する酸素分圧、心臓からの距離と分岐の回数に応じて低下する内圧、流速など内部に含む血流からも異なる情報を受けており、心血管系のエピゲノム情報解析はモデル生物では限界があります。特に内皮細胞は血管の最内層を裏打ちするだけでなく、異物からの防御機構、白血球との相互作用、血液粘稠度の調節、血管緊張性の調節、免疫反応、及び新規血管新生などの役割を持っているため、その多様性こそが特徴であり、その刺激応答への破綻が動脈硬化などの疾患発症にいたることが明らかにされています。心血管内皮細胞に関する網羅的なエピゲノム解析は米国プロジェクトにおいて臍帯静脈内皮細胞の解析が進められている以外に前例がなく、より網羅的かつ系統的な解析が待たれています。解析に用いるヒト検体は、純化したヒト初代培養内皮細胞を用いるほか、埼玉医大、循環器病センター等から提供を受ける予定です。
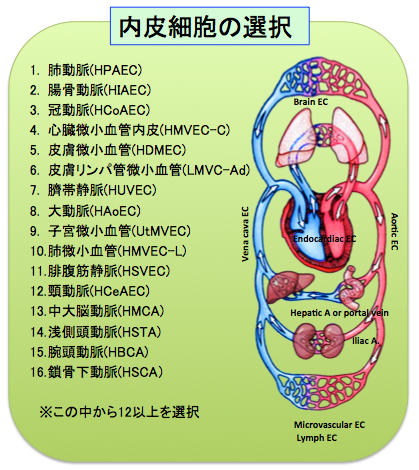
図2
本研究の実施によりヒト正常血管内皮細胞のエピゲノムマップのデータセットを得ることが出来れば、将来的には疾患細胞のエピゲノム情報との比較により、心血管疾患の分子病態の理解が飛躍的に進むことが期待されるばかりでなく、本研究における技術開発により心血管疾患に対するエピゲノム創薬における標的分子同定を加速化するものと期待されます。
 佐々木チーム
佐々木チーム
概要
本研究では、ヒトの胎盤および子宮内膜の細胞を分離・純化し、その標準(正常)エピゲノムを明らかにすることでIHECに貢献します。胎盤と子宮内膜は胎児と母体のインターフェイスを形成しており、生殖発生に不可欠の器官です。これらの器官は胎児の成長に必須であるばかりでなく、習慣流産や不育症、妊娠高血圧症候群(妊娠中毒症)、胞状奇胎、子宮内膜症など様々な疾患と関わっており、その病態の解明には遺伝子発現の研究とともにエピゲノムの研究が必須です。また、これらの研究を推進するため、新たなエピゲノム解析技術の開発にも挑みます。
これまで私たちはゲノムインプリンティングの分子機構について研究してきましたが、その過程で胎盤のユニークなエピゲノム制御を強く認識するに至りました。例えば、1)マウスのX染色体不活性化は胎盤などの胚体外組織でのみインプリンティングを受けますし(父由来Xが選択的に不活性化される)、2)胎盤特異的なゲノムインプリンティングはDNAメチル化に非依存的であることも分かっています。しかし、そのエピゲノム制御についてはごくわずかしか知られていません。最近、私たちは次世代シークエンサーを用いた研究により、胎盤特異的に母性発現を示すとされていたインプリント遺伝子の多くは母体組織の混入によるアーチファクトに過ぎなかったことを見つけました(Okae et al. Hum. Mol. Genet. 2012)。この結果から、胎盤の細胞を分離・純化して解析する必要性と共に、母体側の子宮内膜もあわせて解析する必要性を強く感じました。また、子宮内膜細胞は閉経後委縮してもホルモン剤投与により脱分化して元に戻ることから、間葉系幹細胞のバイオリソース候補のひとつであり、胎盤の絨毛細胞から放出されたmiRNAを含むエクソソームが母体の細胞に取り込まれるなどの新たな制御の可能性も明らかになってきています。
本研究では、ヒトの胎盤および子宮内膜の細胞を分離・純化し、その標準(正常)エピゲノムやトランスクリプトームを明らかにし、様々な疾患の研究に資するためのデータ基盤を築きます。具体的には、妊娠初期および満期の胎盤の細胞性栄養膜細胞と合胞体栄養膜細胞、子宮内膜間質細胞、分泌期・増殖期の子宮内膜上皮細胞を分離して解析を行います。また、妊娠高血圧症候群、胞状奇胎、子宮内膜症などの臨床検体のエピゲノムデータを取得し、標準エピゲノムとの比較検討により病態解明への突破口を開きたいと考えています。また、私たちは乏精子症患者の精子においてインプリント遺伝子が高頻度にDNAメチル化異常を示すことを報告し(Kobayashi et al. Hum. Mol. Genet. 2007)、これが体外受精児にインプリンティング異常が多い原因のひとつではないかと推測しました。そこで今回は網羅的なメチローム解析を行ない、インプリント遺伝子以外の領域においてもメチル化変化がないか検討する予定です。
日本では妊婦のダイエット等により先進国の中で唯一出生体重が低下しており、それが成人後の生活習慣病増加に関係しているのではないかと言われています。また、生殖補助医療が進んだ我国ではすでに全出生児の1/40が体外受精児ですが、それらの児は上記とは逆に出生体重の増加が問題となっており、先天性インプリンティング関連疾患の頻度が高いとの報告もあります。これらの疾患ではエピゲノム異常が強く疑われており、胎盤や子宮内膜のエピゲノムデータは今後これらの異常の原因を解明するためにも役立ちます。私たちは本研究の遂行を通して、エピゲノム研究の推進と世界の人々の健康維持に広く貢献することを目指します。