新薬の開発とエピゲノム
新薬の開発とエピゲノム
患者さん、その家族、医師らにとって、安全で効果の高い新しい薬の登場は、たいへん待ち望まれるものです。

日本人で一生のうちに2人に1人はかかると言われる、がん。がんの治療では、がんの増殖を抑える薬(抗がん剤)がつかわれます。従来の抗がん剤は、がん細胞だけでなく正常な細胞の増殖も抑えてしまうことが問題となっていましたが、近年、がん細胞に特有の蛋白質をブロックして選択的にがん細胞を攻撃する薬-分子標的薬-が開発され、治療効果をあげています。分子標的抗がん剤には代表的なものに、モノクローナル抗体医薬のトラスツズマブ(製品名:ハーセプチン)、小分子薬のグリベック(製品名:イマチニブ)などがあります。
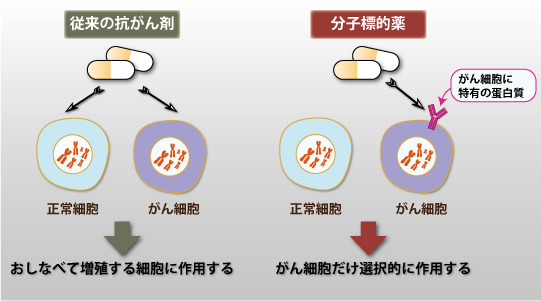
(図1)分子標的薬と従来型の抗がん剤のちがい
強力な分子標的薬をつくるには、がん細胞特有の蛋白質、つまりがん細胞の弱点を見つけることが必要です。しかし、がんの種類や段階によっては、がん細胞の弱点を見つけるのが難しい場合もあります。一方で、がん細胞のエピゲノム状態を調べると、多くのがんでDNAメチル化やヒストンのアセチル化の状態が正常の細胞と比べて異なっており、エピゲノム異常ががんに関係するらしいことが分かってきました。そこで、遺伝子のエピゲノム情報を操作してがんを治療する薬-エピゲノム薬-が登場しました。がん細胞にできた遺伝子の変異は変えられないが(非可逆的)、遺伝子のオン・オフを決めるエピゲノムの目印は付け替え可能である(可逆的)、ここに目をつけたのがエピゲノム薬です。
医薬品として承認された薬には、「アザシチジン(Azacitidine) 」「ボリノスタット(Vorinostat) 」「デシタビン(Decitabine)」「ロミデプシンRomidepsin 」の4種類があります。アザシチジンとボリノスタットは、アメリカ食品医薬品局(FDA)に承認された後、日本でも治療につかわれるようになっています。これらの薬剤は、臨床試験で安全性と治療効果が実証された「骨髄異形成症候群」、「皮膚T細胞性リンパ腫」が適応がん種として指定されています。
| 一般名/商品名 | 標的分子 | 適応がん種 | 承認 |
|---|---|---|---|
| アザシチジン/Vidaza | DNMT | 骨髄異形成症候群 | FDA2004年、日本2011年 |
| ボリノスタット/Zolinza | HDAC | 皮膚T細胞性リンパ腫 | FDA2006年、日本2011年 |
| デシタビン/Dacogen | DNMT | 骨髄異形成症候群 | FDA2006年、日本phase I II |
| ロミデプシン/Istodax | HDAC | 皮膚T細胞性リンパ腫 | FDA2009年、日本phase I II |
(図2)これまでに承認されたエピゲノム薬(2014年2月時点)
既に承認されたエピゲノム薬の適応がん種を広げる研究も、非小細胞性肺がんでの臨床試験など、国外では熱心におこなわれています。さらに、これまでとは異なる作用点をもつ新しいエピゲノム薬の開発も、現在、急ピッチで進められています。
 アザシチジン、なぜ効くの?
アザシチジン、なぜ効くの?
わたしたちの身体の中で細胞が分裂して増えるとき、新しくできる細胞には、元の細胞と同じ情報をもつゲノムDNAが入っています。分裂前の細胞でDNAが正確にコピーされる「半保存的DNA複製」というしくみのおかげです。ではDNAが複製されるとき、DNAについているエピゲノムの情報はどうなるのでしょうか? 実は細胞には、新しくつくられたDNA鎖でも同じ位置にメチル基をつけるしくみが備わっています。このような「DNAメチル化複製」のしくみを可能にしている分子が、DNAメチル基転移酵素(DNMT)です。DNMTのはたらきのおかげで、遺伝子のオン・オフを調整する特定のDNA配列(プロモーター領域CpGアイランド)のメチル化状態は、分裂した娘細胞でも維持されます。
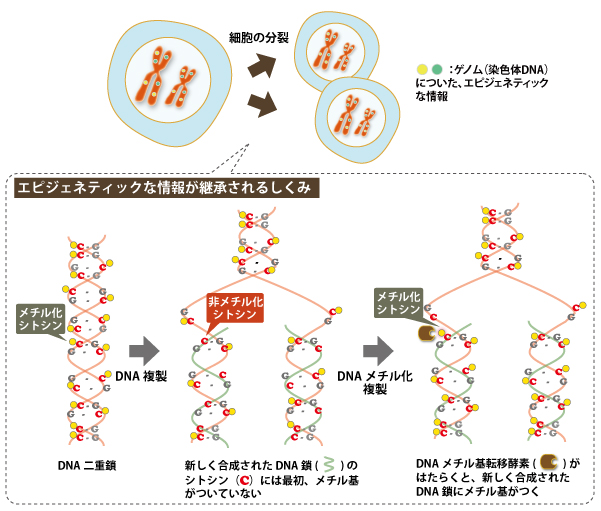
(図3)DNA複製とDNAメチル化複製
健康な細胞ではDNMTがきちんとはたらき、遺伝子のオン・オフのバランスが保たれています。ところが、骨髄異形成症候群やほかの骨髄腫の患者さんの細胞では、DNMTのはたらきに異常が生じ、がん抑制遺伝子のはたらきを調整するDNA配列(プロモーター領域CpGアイランド)の異常な高メチル化が起きています。そのため、がん抑制遺伝子の多くがオフになり、がんが増殖しやすい状態になってしまっているのです。
アザシチジンやデシタビンは、DNAメチル基転移酵素(DNMT)阻害剤の1つです。これらの薬剤はDNAを構成するシトシンと化学構造が似ており(図4で比較。シチジンはシトシンに糖が結合した状態)、シトシンの代わりにDNAの中に入り込むことで、DNMTによるメチル化をじゃまする作用をもちます(図5)。この作用によって、がん抑制遺伝子の異常な高メチル化がほぐれて、がん抑制遺伝子がきちんとはたらくようになり、治療効果が出ると考えられています。
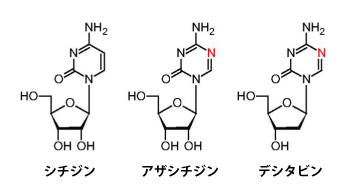
(図4)DNAメチル基転移酵素(DNMT)阻害剤の化学構造
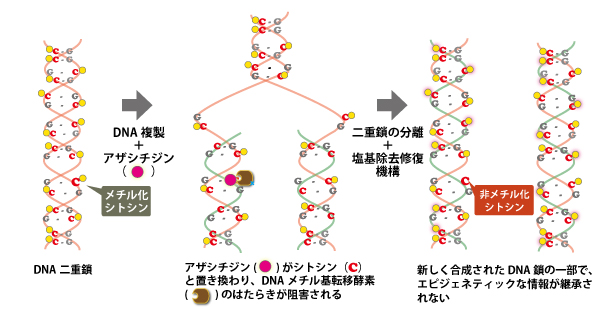
(図5)アザシチジンがDNAメチル基転移酵素(DNMT)を阻害するしくみ
 ボリノスタット、なぜ効くの?
ボリノスタット、なぜ効くの?
エピゲノムの目印はDNAメチル化だけではありません。DNAが巻き付いている糸巻きのような蛋白質「ヒストン」に刻まれたヒストン修飾が、DNAメチル化に並ぶエピゲノムの目印として知られています。ヒストン修飾の正体は、ヒストンのテイル(尻尾)部分に付加されるアセチル基やメチル基の化学修飾のパターンです(図7)。このパターンはヒストンコードともよばれます。ヒストンコードが異なると同じ遺伝子でもはたらき方が異なってきます。そして、細胞が分裂し娘細胞ができるとき、DNAメチル化複製と同様に「ヒストン修飾の継承」がおこるとされています。
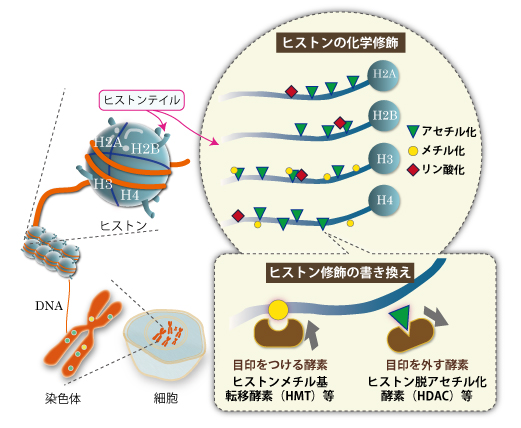
(図6)ヒストンの化学修飾と書き換え
ヒストンの化学修飾(アセチル化・メチル化・リン酸化)のパターンは、さまざまな酵素によって書き換えられる。たとえば、ヒストン脱アセチル化酵素(HDAC)はアセチル基を取り除き、ヒストンメチル基転移酵素(HMT)はメチル基を付加する。
ボリノスタットは、ヒストン脱アセチル化酵素(HDAC)阻害剤の1つです。ヒストン修飾を調整するHDACをブロックし、アセチル基を取り除く作用(脱アセチル化)を弱めます。皮膚T細胞性リンパ腫の患者さんの細胞ではHDACはじめヒストン修飾に関わる酵素のはたらきに異常が生じており、ボリノスタットは脱アセチル化の作用を弱めることで、がんの治療に効果をあげると考えられています。
 エピゲノム薬はいつ発見された?
エピゲノム薬はいつ発見された?
エピゲノム薬は、日本では承認されてから5年もたたない、とても新しい薬です。しかし実は、エピゲノム薬の一部は、いまから50年以上も前に合成されていました。1960年代、DNA二重らせんを構成する塩基の化学構造が盛んに研究され、シトシン塩基と似た構造をもつ分子として、シタラビン、アザシチジン、デシタビンが開発されました。シタラビン(Cytarabine, ara-C)は細胞分裂時のDNA合成を強力に阻害する作用があり、骨髄性白血病の抗がん薬としてつかわれるようになりました(商品名キロサイド)。しかし、アザシチジンとデシタビンは、白血病の抗がん剤としての効果はあるが、細胞毒性が強くつかいものにならないとされ、薬剤としての開発は停滞してしまったのです。
ところが1980年、アザシチジン・デシタビンに再び脚光が集まります。ピーター・ジョーンズ博士(現・米国南カリフォルニア大学ノリスがんセンター教授/IHEC米国チーム)が、これらの薬剤がDNAメチル化酵素を阻害して高メチル化状態を元に戻し、遺伝子のオフ状態を解消することを、明らかにしたのです。また、骨髄異形成症候群の患者さんに対する臨床試験でも、投与量を過去の研究の20分の1に減らすことで、“細胞毒性のデメリット”が減って“過剰なメチル化状態を治す”メリットが勝り、従来法よりも高い治療効果が出ることがわかったのです。そこで、「アザシチジンのようなDNAメチル化阻害剤が、エピゲノム異常を元に戻す、夢の薬となるのではないか?」という期待が高まり、再び研究が加熱しました。
2000年頃には、ヒトに対する生理作用や安全性の試験を経て、DNAメチル化阻害剤の有効性を検証する大規模無作為化比較試験が海外で始まります。そして2004年にはアザシチジンが、2006年にはデシタビンが、エピゲノム薬として米国FDAに承認され、エピゲノム薬は世界各国の医療現場でつかわれるようになったのです。