精神疾患とエピゲノム
精神疾患とエピゲノム
こころの病気、メンタルヘルスは、家庭、学校、職場で切実な問題となっています。精神疾患で医療機関にかかる人の数は2011年で320万人を超え、もっとも多い疾患がうつ病と統合失調症です。うつ状態と躁(そう)状態を繰り返す慢性の疾患はとくに双極性障害とよばれます。
精神疾患には、脳の状態が大きく関わります。怒り、悲しみ、喜び、共感、記憶、学習…。私たちの感情と行動を生み出す器官が脳・神経系です。脳の中では神経細胞とそれをとりまくグリア細胞が複雑なネットワークをつくり、身体全体の20%ものエネルギーを消費して、化学物質・電気信号の伝達を活発におこなっています。このような脳の細胞のはらたきは、ゲノム上の遺伝子をはじめ様々な分子によってコントロールされているのですが、“こころ”の状態に実際に遺伝子がどう関わるのかは、まだ多くのことが分かっていません。
しかし近年、いくつかの精神疾患では、遺伝子の変異や、遺伝子のオン・オフを決めるエピジェネティックな目印の異常が、病気のなりやすさに結びつくという報告が出はじめています。ゲノム・エピゲノムを切り口とした研究が進み、精神疾患の理解、そして将来的には根治的な治療へとつながることが期待されます。

 統合失調症・双極性障害とエピゲノム
統合失調症・双極性障害とエピゲノム
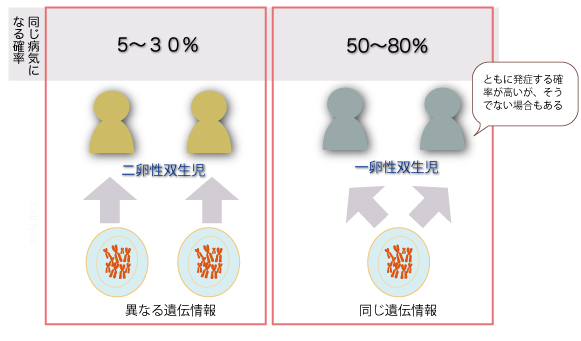
100%ではないが遺伝する
家族研究や双生児研究によって、統合失調症と双極性障害の発症には遺伝的な要因が関わることが明らかになっています。たとえば、同一のゲノム情報をもつ一卵性双生児と、異なるゲノム情報をもつ二卵性双生児を比べた時に、兄弟ともに病気を発症する確率が、一卵性双生児の方が二卵性双生児よりも高いからです(一卵性双生児:50〜80%、二卵性双生児:5〜30%)。とはいえ、100%の発症一致率ではないので、単一の遺伝子の異常が原因で必ず病気になる、という単純なものではありません。疾患には、環境的な要因—胎児期の母親の低栄養・ウイルス感染、出生後の虐待・ストレスなど--も、複雑に絡み合っていると考えられています。
要因となる遺伝子は1つではない
統合失調症と双極性障害では、遺伝的な要因となる遺伝子を特定する研究が古くから行われています。患者の血液のDNAを用いてゲノム情報を網羅的に調べた2007年〜2011年の研究では、要因となる遺伝子群がいくつかリストアップされました。しかし、個々の遺伝子と統合失調症・双極性障害との関連性はオッズ比*で1.2程度と、病気に対する影響が小さく、診断や治療に利用するには未だ難しい状況です。今後は、コピー数多型とよばれる変異の解析、複数の遺伝子の組み合わせによる解析、頻度が稀でオッズ比の高い変異の探索など、さまざまなアプローチで研究を進める必要があります。
*オッズ比:
ある因子(栄養、年齢、遺伝子の変異など)が病気の原因であると仮定したときに、その因子が病気のなりやすさにどの程度関わるかを統計的に示す数値。ある遺伝子の変異と病気との関係を示すオッズ比が1ならば、変異をもつ人ともたない人で病気のなりやすさは同じ。オッズ比が2.5ならば、変異をもつ人はもたない人と比べて2.5倍病気になりやすいと考える。
エピゲノムでわかること
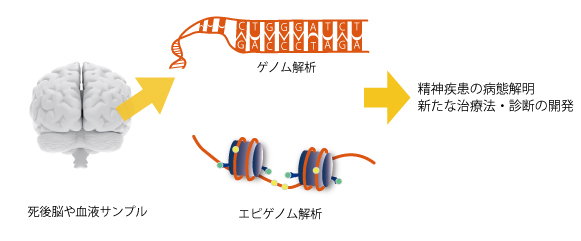
これまでのゲノム解析だけでは分からない、精神疾患の分子遺伝学的な背景を探るため、研究者が解析対象として注目しているのが、エピゲノムです。エピゲノム状態は環境要因の影響を受け変動することが知られています。特に脳組織におけるエピゲノム状態は、精神疾患の発症に至った環境要因の影響を反映している可能性があります。そのため、脳の細胞を直接調べることが重要になります。
代表的な研究として、統合失調症・双極性障害の患者と健常者で死後脳の前頭葉を採取し、脳ゲノムの約12,000カ所のCpGアイランドでDNAメチル化状態を網羅的に解析した結果があります[1]。この研究では、脳の発達や神経伝達に関係する遺伝子領域でいくつものメチル化異常(エピゲノムの異常の一つ)を特定することに成功しました。また、自殺者の死後脳のウェルニッケ野を調べた研究[2]では、脳由来神経栄養因子(BDNF)という神経細胞の成長に関わる遺伝子でメチル化異常がおきていることが報告されています。
死後脳を解析対象とした研究では、研究の重要性をご理解頂いて試料を提供して頂くことの困難さに加え、患者さんの死因や服薬状況、死後経過時間などの影響を正確に評価する必要があります。また、脳組織は多種類の細胞で構成されるため、エピゲノム情報などデータの解析は注意深く進める必要があります。このような難しさはありますが、今後、解析技術が改良され、またIHECで多種多様な脳神経細胞の標準エピゲノムが決定されると、ヒトの脳のエピゲノム研究はさらに進展していくでしょう。
動物実験によるエピゲノム研究
ラットをつかった実験では、生まれた後に親ラットから引き離されあまり可愛がってもらえなかったラットは、海馬(学習・記憶に関わる脳の領域)の神経細胞のグルココルチロイド受容体遺伝子のメチル化状態に異常が起き、その結果、ストレスに弱くなるという報告がされています[3]。ほかにも、ラットやマウスをつかったいくつかの実験により、ストレスや栄養状態が脳の細胞のエピゲノム状態を変化させ、記憶、学習、行動に影響を与える可能性が指摘されています。
取材協力:
岩本和也(東京大学医学系研究科分子精神医学講座特任准教授):

参考文献:
○脳ゲノム多様性と精神疾患, 文東美紀、笠井清登、加藤忠史、岩本和也, 日本生物学的精神医学会誌 2012,23:29-33
○うつ病の脳科学--精神科医療の未来を切り開く, 加藤忠史, 幻冬舎新書
[1]Epigenomic profiling reveals DNA-methylation changes associated with major psychosis, Mill J,et al, Am J Hum Genet, 2008.
[2]Increased BDNF Promoter Methylation in the Wernicke Area of Suicide Subjects, Keller S et al, Arch Gen Psychiatry, 2010.
[3]Epigenetic programming by maternal behavior, Weaver IC et al, Nat Neurosci, 2004.